Assunto
Mineralogia
Idade recomendada
Qualquer idade
Dificuldade
Moderado
Custo
Gratuito
- Simular a síntese de minerais.
- 250 ml de água
- 2 copos de vidro (100 ml)
- 1 fonte de aquecimento (ebulidor mergulhão 220V)
- 1 palito de picolé
- 1 pinça de metal ou plástico
- 1 papel filtro (coar café)
- 1 m de linha de costura
- 1 colher chá
- 1 funil 50 g de cloreto de sódio (sal de cozinha).
⬢ 1. Prepare uma solução saturada utilizando o cloreto de sódio. Para isso é importante conhecer o coeficiente de solubilidade do Cloreto de Sódio, ou seja, a quantidade suficiente de soluto (NaCl) para saturar 100g (100ml) do solvente (H20) a uma determinada temperatura, que é a seguinte para água quente e fria:
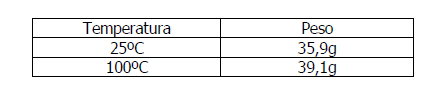
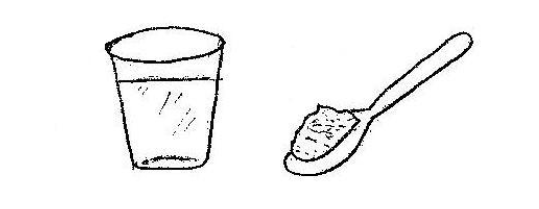
⬢ 2. Utilize um copo de vidro medindo 100 ml, como medida para a água. Adicione 55g de NaCl em 100 ml de água.
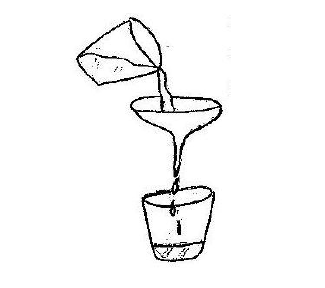
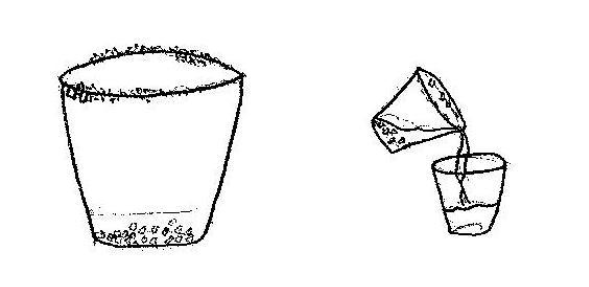
⬢ 3. Misture bastante a solução até verificar que o sal não está mais dissolvendo. Feito isso filtre com o auxílio do funil a solução, utilizando o outro copo. Garanta que nenhum cristal fique no fundo do copo onde está a solução filtrada. Coloque a solução em um local onde não será perturbada por alguns dias, dependendo se o clima estiver úmido, até por semanas. Descarte o funil.
⬢ 4. Após o tempo de descanso observe que houve a formação de diversos cristais de NaCl no fundo e talvez nas bordas do copo e ainda há solução no copo. Entorne a solução no outro copo e reserve-o.
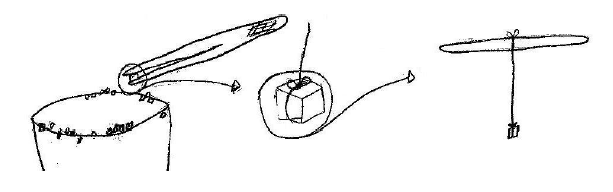
⬢ 5. Com a pinça retire um cristal que esteja muito bem formado, com todas as suas faces, arestas e vértices perfeitos (um cubo perfeito). Com uma das pontas da linha dê um nó em volta do cristal escolhido e a outra extremidade da linha é amarrada também com um nó na posição central, bem no meio do palito de picolé, assim ao segurar o palito de picolé o cristal fica dependurado.
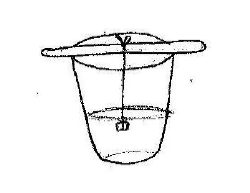
⬢ 6. Agora descanse o palito de picolé nas bordas do copo com a solução, de forma que o cristal fique suspenso no líquido sem tocar as bordas e o
fundo do copo (mais ou menos a meia altura da solução). Deixe descansar por mais alguns dias e observe o que acontece.
⬢ 7. Se puder, deixe o copo descansando por vários dias até que toda a solução desapareça e observe o que resta.
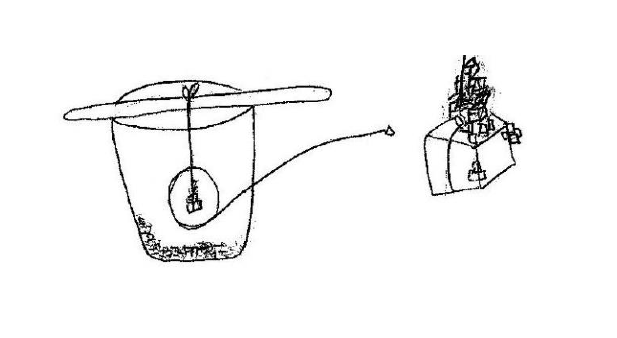
Por que apareceram cristais numa solução de NaCl e H2O, onde anteriormente não havia nenhum cristal?
R.: Porque no processo lento de resfriamento da solução ela se torna supersaturada à temperatura ambiente, fazendo com que os íons de
Na e Cl, antes dissolvidos na solução, se liguem, através de ligações iônicas, precipitando a substância sólida NaCl que se organiza
tridimensionalmente como um cristal cúbico. O sal que usamos na cozinha é uma grande quantidade de cristais tão minúsculos que dificilmente vemos sua forma geométrica cúbica.
Até quando os cristais serão formados nessa solução?
R.: Teoricamente, até a solução deixar de ser supersaturada e passar a ser saturada, quando então os cristais não se formarão mais. No
entanto, como o sistema em solução está aberto, em contato com o ar, há também a evaporação lenta da água, tornando a solução continuamente supersaturada que, por sua vez, leva à precipitação, também contínua, de cristais ou o crescimento daqueles que já existiam até a evaporação total da água.
Por que no fundo do copo há cristais não perfeitos, que são aqueles em que nem todas as faces, arestas e vértices são bem formados?
R.: Porque o crescimento do cristal é limitado pelas bordas e fundo do copo, já que dois corpos não ocupam a mesma posição no espaço,
fazendo com que alguns não tenham a forma cúbica, mas sim a forma do copo. Cristais crescendo próximos uns aos outros também interferem nas formas finais desses cristais.
Ao separar um cristal e mergulhá-lo novamente na solução, percebe-se que com o tempo ele cresce. Como se explica esse fenômeno?
R.: Ele cresce porque ele próprio é uma superfície para precipitação de mais NaCl, sendo que este último se une ao primeiro cristal obedecendo sua estrutura cristalina anterior. Por estar limitado apenas por líquido, ele tende a crescer por igual tridimensionalmente.
Às vezes ele cresce como um cristal único, às vezes como um aglomerado de cristais. Como você explicaria essa diferença?
R.: Ao separar um cristal com a pinça é possível separar de fato um único cristal, para separar mais de um cristal, é necessário o crescimento de dois ou mais cristais aglomerados. Pode ainda acontecer de crescer um (uns) cristal (ais) sobre outro (os), resultando nos aglomerados.
Esse experimento tem alguma relação com a formação de minerais? Por quê?
R.: Sim, porque é a simulação do que acontece na formação de minerais resultantes da precipitação química em ambientes aquosos ou mesmo no magma. Também simula as diferenças de formas geométricas dos minerais, relacionadas ao tempo de formação e espaço para os minerais. Ou seja, quanto mais lento o tempo de formação (no caso, resfriamento lento da solução) e mais espaço para crescerem, maior probabilidade de cristais geometricamente perfeitos.

Você sabia?
Os bens minerais têm uma importância significativa para a sociedade, a tal ponto que as fases de evolução da humanidade são divididas em função dos tipos de minerais utilizados: idades da pedra, do bronze, do ferro, etc. O caráter pioneiro da mineração resultou em novas fronteiras econômicas geográficas, abrindo espaço para o desenvolvimento e gerando oportunidades econômicas ao longo da história da humanidade
Instituto de Geociências da USP
Rua do Lago, 562
Cidade Universitária São Paulo, Brasil
- +55 (11) 26480018
- geohereditas@gmail.com



